2025年发表于《Frontiers in Immunology》的一项研究,通过挖掘美国FDA不良事件报告系统(FAERS)数据库,首次对新型PD-1抑制剂Tislelizumab的上市后安全性进行全面评估。研究整合2024年全年2,075例用药报告,采用先进的不成比例分析方法,不仅验证了药物说明书已知风险,更揭示出掌跖红肿综合征、免疫介导性膀胱炎和肾囊肿等未记载不良反应,同时证实其免疫相关不良事件(irAEs)风险显著低于同类药物。这项研究为临床安全用药提供了关键证据,也凸显了公共数据库在药物警戒中的巨大潜力。

Tislelizumab是一种高亲和力抗PD-1单克隆抗体,2024年3月获FDA批准用于食管癌和胃癌治疗。其解离速率较纳武利尤单抗和帕博利珠单抗分别慢50倍和100倍,在多项临床试验中显示出显著抗肿瘤活性(如RATIONALE-303研究)。然而,免疫检查点抑制剂(ICIs)普遍存在的免疫相关不良事件(irAEs)可能引发器官损伤,而临床试验因样本量有限难以全面捕捉罕见不良反应。
技术价值聚焦: FAERS作为全球最大的药物警戒数据库,整合了自发上报的全球药物不良事件信息。本研究通过其海量真实世界数据,克服了传统临床试验的样本量限制,为全面评估Tislelizumab安全性提供了不可替代的平台。
研究采用2024年1-4季度FAERS数据,经严格去重和标准化处理(MedDRA v27.1术语集),最终纳入2,075例以Tislelizumab为首要怀疑药物的报告,覆盖3,795条不良事件记录。核心分析方法包括:
不成比例分析: 综合使用报告比值比(ROR)和贝叶斯置信传播神经网络(BCPNN)两种算法,双标准验证信号显著性(需同时满足ROR-95%CI下限>1且IC-IC025>0)。
时间分析: 采用Weibull分布模型计算不良事件发生的中位时间及累积发生率。
混杂控制: 对顺铂、奥沙利铂等5种常见联用药物进行敏感性分析。
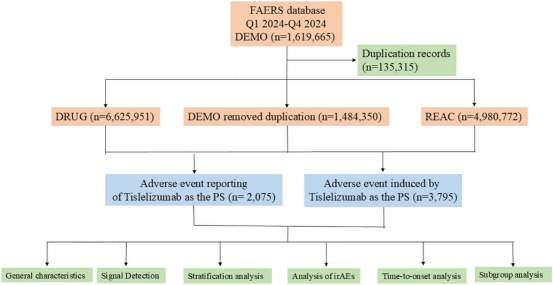
图1: Tislelizumab不良事件分析流程图,从FAERS原始数据筛选到最终纳入分析的技术流程(DEMO文件初筛→去重→药物关联性判定→分层分析)。
99.99%报告来自中国,99.6%由医疗专业人员提交。主要适应症为肺癌(29.2%)、食管癌(9%)、肝癌(7.1%)。31.2%报告导致住院,0.8%导致死亡(表1)。
表1: 汇总报告来源国家、上报者类型、给药途径、适应症分布及临床结局等关键信息。(汇总自原文表1)
特征 | 病例数 | 比例(%) |
报告国家(中国) | 2,073 | 99.99% |
医疗专业人员上报 | 2,066 | 99.6% |
主要适应症(肺癌) | 605 | 29.2% |
导致住院 | 647 | 31.2% |
导致死亡 | 18 | 0.8% |
在97个显著信号(涉及15个系统器官分类)中:
已知信号验证: 骨髓抑制(ROR=245.25)、肝功能异常(ROR=46.34)、瘙痒(ROR=4.02)、剥脱性皮炎(ROR=88.43)与说明书一致。
未记载信号: 掌跖红肿综合征(ROR=4.60)、免疫介导性膀胱炎(ROR=246.09)、肾囊肿(ROR=7.75)为首次大样本报道。
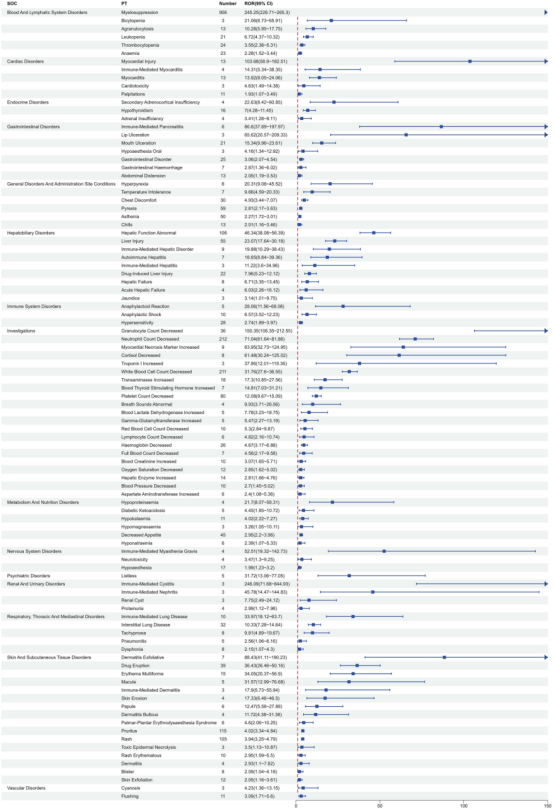
图3: Tislelizumab在PT水平的不良事件信号强度。以森林图形式展示各首选术语(PT)的ROR值及置信区间,直观比较信号强度。
在726例irAEs中,皮肤毒性(ROR=2.61)、肝炎(ROR=4.36)、内分泌毒性(ROR=5.01)信号最强。关键发现:Tislelizumab的总体irAEs信号强度(ROR=1.69)显著低于其他ICIs(如纳武利尤单抗ROR=2.21,伊匹木单抗ROR=3.01)(图4)。
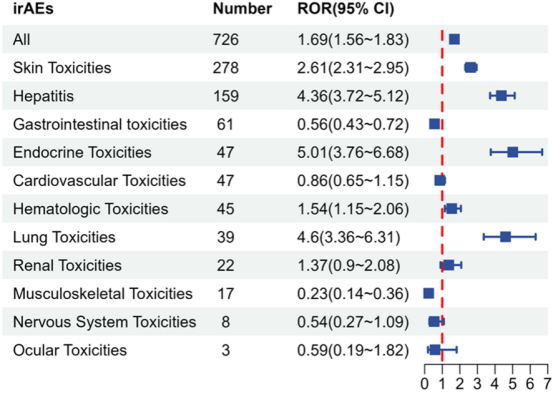
图4:Tislelizumab相关irAE信号。 柱状图对比不同类别irAEs的ROR值,突出皮肤、肝脏和内分泌毒性信号。
82.9%不良事件发生在用药后30天内。中位发生时间:所有AE为11天(IQR:6-24),irAE为21天(IQR:6-50.5)。Weibull分布分析显示二者均呈“早期失效模式”(表4)。
事件类型 | 中位发生时间(天) | Weibull形状参数(β) | 失效模式 |
所有AE | 11 (IQR:6-24) | 0.679 | 早期失效 |
irAE | 21 (IQR:6-50.5) | 0.655 | 早期失效 |
表4: Tislelizumab相关AE及irAE的Weibull分布分析。表中包含中位发生时间、尺度参数(α)、形状参数(β)及失效模式类型。
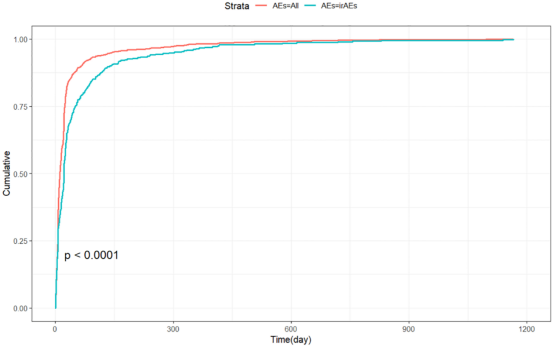
图6: Tislelizumab不良事件累积发生率曲线。Kaplan-Meier曲线展示随时间推移的AE和irAE累积发生率,Log-rank检验P<0.0001。
本研究通过FAERS大数据系统验证了Tislelizumab的三类关键安全性特征:
确认骨髓抑制、肝毒性等说明书记载风险,并发现掌跖红肿综合征、免疫介导性膀胱炎和肾囊肿三个潜在新信号;
明确84.9%不良事件发生于治疗首月,提示早期监测窗口期;
证实其irAEs风险显著低于主流PD-1/PD-L1及CTLA-4抑制剂(ROR低30%-65%)。
这些发现为临床实践提供重要指导:对于irAEs高风险人群(如既往免疫治疗不耐受者),Tislelizumab可能是更优选择;而新发现的泌尿系统信号提示需加强治疗期间尿常规及影像学监测。
数据库挖掘的科研价值:低成本高效益的研究范式
本研究凸显了FAERS等公共数据库在药物安全性研究中的四大优势:
优势维度 | 本研究实现路径 | 科学价值 |
时效突破 | 利用现存2024全年数据 | 将上市后安全性评价周期缩短至1年 |
成本控制 | 省去现场调查环节 | 节约百万级科研经费 |
混杂控制 | 多变量分层+敏感性分析 | 有效识别药物特异性信号 |
罕见事件捕获 | 全球自发报告整合 | 检出率<0.1%的罕见不良事件 |
这种模式特别适合:①预算有限但需大样本验证的课题;②需要快速评价新药安全性的监管需求;③跨区域药物不良反应比较研究。随着各国药监机构开放更多数据库资源,基于真实世界证据的药物警戒研究将迎来更广阔空间。
参考文献
Li C, et al. Post-marketing safety concerns with Tislelizumab: a disproportionality analysis of the FDA adverse event reporting system. Front Immunol. 2025;16:1596842. doi:10.3389/fimmu.2025.1596842